این سیستم در اصل سیستم دفاعی باکتریها بر ضد ویروسهای مهاجم به باکتری ( باکتریوفاژ ) است و در سال 2005 توسط پرفسور فرانسیسکو موخیکا اسپانیائی منتشر شد . سپس این ایده بوجود آمد که با توجه به اینکه این سیستم یک قیچی DNA بسیار اختصاصی برای توالیها خاص است ، در پزشکی نیز میتواند کارآمد باشد . پرفسور جنیفر دودنا از پیشگامان استفاده از آن برای ویرایش ژن Gene Editing در سال 2020 برای آن جایزه نوبل گرفت . سال گذشته اولین دستکاری ژنتیک بر اساس این تکنولوژی در آمریکا مجوز گرفت و اخبار جدید مبتنی بر حذف کروموزوم اضافه در سندروم داون با این روش منتشر شده است .
نویسنده : دکتر محمد زهرائی
مکانیزم دفاع باکتری در برابر ویروس
لغت CRISPR مخفف clustered regularly interspaced short palindromic repeats است . در بررسی توالی ژنوم باکتریها مشاهده شده بود که تکرارهای منظمی از توالیها وجود دارد ، یعنی مناطق تکرار شونده خوشهای با فاصله اما یک نکته بسیار مهم ، این تکرارها دقیقا تکرار هم نیستند یعنی پالیندرومیک است ، یعنی تکرار با توالی برعکس ( پالیندرومیک ) و البته مکمل .
وقتی RNA از روی این DNA رونویسی شود باعث می شود که این مناطق پالیندرومیک در روبروی هم به هم متصل شده و سر آن به شکل یک لوپ یا ته سنجاق سر hairpin می شود .
همامطور که در بخش اساس سلولی حیات و پزشکی مولکولی اشاره شد ، تمام عملکرد حیات توسط اشکال سه بعدی و چفت شدگی آنها به ایجاد میشود ، حتی قبل از ایجاد پروتئینها که ایجاد اشکال سه بعدی را بسیار کارآمد انجام میدهند ، مولکولهای RNA در یک راه حل باستانی با همین ایجاد اشکال دو رشته و دایره و کره در هم پیچیده اشکال سه بعدی درست میکردند که کار زبانههای کلید برای چفت شدن و انجام هدایت شده واکنشهای شیمیائی را انجام میدادند و شاید به نوعی آنزیمهای اولیه را ایجاد کرده بودند . امروزه هم محتوای RNA ریبوزوم که هرچه موجود در رده پائینتر تکاملی است محتوای بیشتری است و ساختار tRNA موید این نقش RNA است .
پس توالیهای پالیندرومیک برای شکل دادن یک مولکول سه بعدی RNA است ، چرا ؟ برای اینکه بتواند با یک پروتئین و شکل سه بعدی آن چفت شدگی تشکیل دهد .
حال در بین این مناطق خوشهای پالیندرومیک ، مناطقی از توالی ژنوم باکتریوفاژ کشف شد ، و این کشف از کارکرد مجموعه CRISPR رمز گشائی کرد ، یعنی باکتری یا اجداد آن دچار حمله باکتریوفاژ شده ، باکتریوفاژ DNA خود را به داخل باکتری تزریق کرده تا باکتری از روی آن ژنوم و پروتئین ویروس را بسازد و تکثیر کند ، باکتری به نحوی از این حمله جان به در برده ( مثلا حمله کم تعداد ویروس ) ، حالا قطعهای از DNA ویروس در بین خوشههائی از تکرار پالیندرومیک وارد DNA باکتری شده .
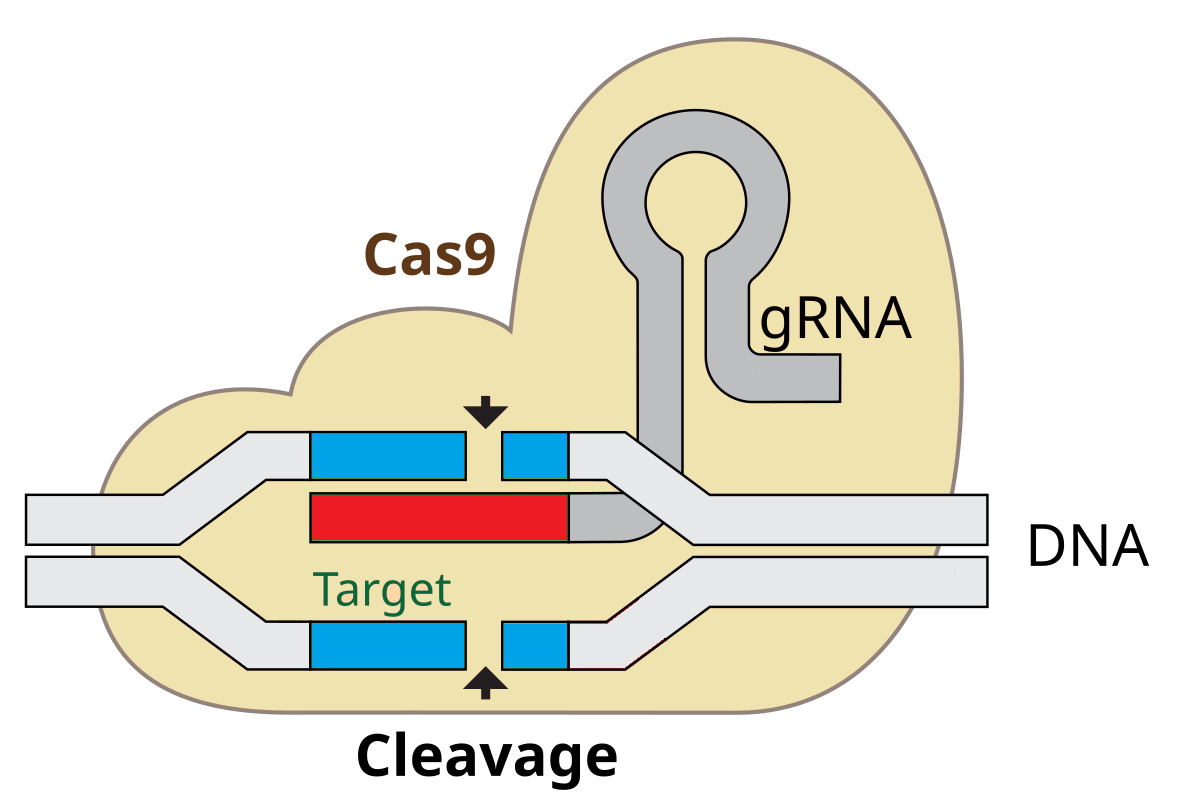
پس وقتی از روی این بخش DNA در فرآیند رونویسی RNA تولید می شود ، یک قطعهای داریم که میتواند به صورت بسیار اختصاصی با یک توالی از DNA ویروس متصل شود ، بقیه RNA با توجه به توالیهای پالیندرومیک مکمل ، روی هم تا میخورد و اشکال دو رشته و حلقه درست میکند که میتواند حجمهای سه بعدی ایجاد کند که با یک پروتئین خاص یعنی CRISPR Associated Protein CAS چفت شدگی ایجاد کند . کار CAS برش DNA است .
پروتئین CAS1-CAS2 یک قطعه از DNA باکتری را برش زده و آن را در داخل DNA ویروس بین خوشه های پالینرومیک میکارد ، حالا وقتی DNA باکتری رونویسی شود ، یک GuideRNA ( gRNA ) ایجاد میشود با یک بخش دورشتهای و لوپ که در انتهای آن RNA وجود دارد که مکمل یک توالی در DNA ویروس است .
پس به محض اتصال بخش هدف گیر کمپلکس CRISPR-CAS9 به یک توالی از DNA وارد شده ویروس ، DNA ویروس در همان جا توسط CAS9 بریده شده و فرآیند تولید و تکثیر ویروس از روی آن متوقف میشود .
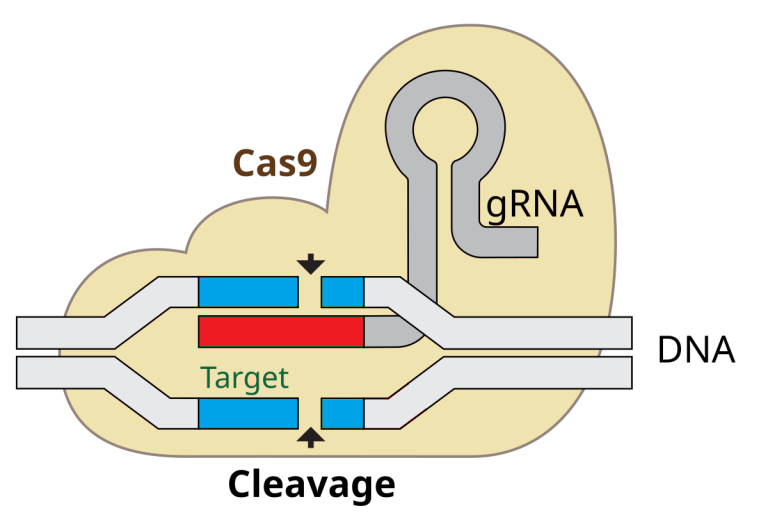
حالا با وجود این توالی از DNA ویروس در ناحیه CRISPR ، باکتری و تمام کلون که از تکثیر آن ایجاد میشود ، در برابر آن ویروس مصون خواهد بود .
کاربرد CRISPR برای اصلاح ژن Gene Editing
وجود توالیهای مربوط به CRISPR در چند مرکز تحقیقاتی جهان مثل ژاپن و اسپانیا کشف شده بود اما با انتشار مکانیسم عملکرد توسط پرفسور موخیکا از دانشگاه آلیکانته اسپانیا در سال 2005 ، توجهات را به خود جلب کرد . از یک نظر از بابت اینکه واقعا باکتری با چه روش جالبی میتواند از خود در برابر ویروس دفاع کند .
مهمتر اینکه امکانی داریم که بر اساس آن می توانیم انتهای هدف گیر را برای اتصال هر توالی خاصی طراحی کنیم و اگر کمپلکس را بتوانیم به داخل هسته سلول برسانیم ، باعث برش ژنوم در آن نقطه میشود ، یعنی امکان برش هر توالی معیوبی را در داخل ژنوم داریم .
دکتر جنیفر دودنا و دکتر امانوئل کارپنتر پیشگامان استفاده از این کمپلکس در پزشکی شدند و در سال 2020 برنده جایزه نوبل شیمی ( که به نحقیقات بیوشیمی نیز اعطاء میشود ) شدند .

اولین کاربرد مجوز گرفته CRISPR در درمان
برای اولین بار مکانسیم CRISPR-Cas9 برای درمان آنمی سیکل سل ( کم خونی داسی شکل ) به کار گرفته شد به نام تجاری محصول CASGEVY (exagamglogene autotemcel) که ساخته شرکت Vertex Pharmaceuticals Incorporated است که توسط دکتر جنیفر دودنا پایهگذاری شده است . این محصول سپس در مورد بیماری بتا تالاسمی ( نوع شایع تالاسمی ) به کار گرفته شد .
آنمی سیکل سل در اثر یک اختلال ژنتیکی ایجاد می شود که باعث ساخت زنجیره معیوب هموگلوبین می شود که توانائی کمتر حمل اکسیژن دارد و باعث تغییر شکل گلبولهای قرمز میشود و گاها با گیر کردن و تجمع آنها در رگها ، حمله دردناک و کاهش اکسیژنرسانی ایجاد میشود .
درمان معمول آن درمانهای حمایتی است و عموما افراد طول عمر طبیعی ندارند.
بتا تالاسمی بیماری است ژنتیکی که در اثر اختلال ساخت زنجیره بتا هموگلوبین ایجاد می شود. در نتیجه بیمار دچار اختلال ساخت هموگلوبین و عوارض ناشی از آن آن می شود که در شکال ماژور ( معیوب بودن هر دو آلل ) آن بسیار ناتوان کننده و بدون درمان باعث مرگ زودرس در کودکی می شود .
درمان قدیمی آن انتقال خون مکرر و البته تجویز داروهائی است که آهن بیش از حد تجمع یافته در اثر انتقال خون مکرر را از بدن خارج کند .
درمان جدیدتر پیوند مغز استخوان است یعنی کل سلولهای بنیادی خونی فرد از بین برده می شود و سلولهای بنیادی خونی با ژنتیک سالم از اهداء کننده سازگار وارد بدن شده و بیماری اصلاح میشود .
حالا CRISPR یک امیدی ایجاد کرده است ، اگر بتوانیم سلولهای بنیادی خونساز مغز استخوان را از بیمار بگیریم و در خارج از بدن با مکانیسم CRISPR ویرایش ژن Gene Editing بکنیم و دوباره به بدن برگردانیم ، از درمان پیچیده و نسبتا خطرناک از بین بردن کل سیستم خونی فرد و بعد جایگزینی با اهداء کننده اجتناب کنیم .
در اولین تلاشها تلاش برای ویرایش ژن معیوب زنجیره بتا هموگلوبین بر روی کرورموزوم 11 ، انجام شد اما یک مانع بزرگ وجود دارد ، بخش معیوب توالیهای مختلفی دارد پس با یک توالی gRNA نمیتوان مسئله را حل کرد و نیاز به استفاده از کمپلکسهای مختلف به شدت راندمان و فایده به هزینه را کاهش میدهد .
پس یک روش هوشمندانه ایجاد شد ، در دوره جنینی هموگلوبین F در گلبولهای قرمز ایجاد میشود . هموگلوبین معمول دارای دو زنجیره آلفا و دو زنجیره بتا است ، هموگلوبین جنینی دارای دو زنجیره الفا و دو زنجیره گاما است .
پس از دوران جنینی ژن BCL11A باعث سرکوب تولید هموگلوبین F ( زنجیره گاما ) می شود و از نظر تکنیکی میتوان آنرا با برش توسط CRISPER-Cas9 غیر فعال نمود . به این ترتیب پس از دوران جنینی هم هموگلوبین F تولید شده و جایگزین هموگلوبین معیوب داسی یا زنجیره بتای ناکارآمد شده و مشکلات تا حد قابل توجهی بهبود مییابد .
ژن BCL11A (B-cell CLL/lymphoma 11A) یکی از ژنهای بسیار مهم در تنظیم بیان ژنها در بدن انسان است که نقشهای کلیدی در سیستم ایمنی، خونسازی (hematopoiesis)، رشد مغز، و بیان ژنهای مربوط به هموگلوبین ایفا میکند . محل قرارگیری آن در کروموزوم 2 است و نوع پروتئین آن فاکتور رونویسی (transcription factor) است . فاکتورهای رونویسی پروتئینهائی هستند که در انتهای مسیر سیگنالینگ سلولی فعال شده و وارد هسته شده و با اتصال به یک ناحیه خاص باعث فعالیت یا خاموش شدن یک ژن میشوند . این پروتئین امروزه در مورد سیستم خونساز و سیستم عصبی خیلی مورد توجه تحقیقات مختلف است.
اخیرا Ryotaro Hashizume از دانشگاه Mie ژاپن موفق شده است در کشتهای سلولی ، با استفاده از کمپلکس CRISPR-Cas9 ، کروموزوم اضافه را در سندروم داون غیر فعال کنند .
تحقیقات حال حاضر در مورد استفاده از CRISPR-Cas9 :
برای اینکه برداشتی از وسعت تحقیقات ویرایش ژن داشته باشیم به موارد در حال تحقیق ، اشاره میکنیم .
- درمان بیماریهای ژنتیکی انسان
بتا تالاسمی درمان موفق با CRISPR-Cas9 در بیماران با با ویرایش ژن BCL11A و فعالسازی ژن هموگلوبین جنینی (شرکت Vertex و CRISPR Therapeutics).
آنمی سلول داسیشکل (Sickle Cell) اولین درمان ژنی تأییدشده با CRISPR در انسانها؛ با ویرایش ژن BCL11A برای فعال کردن هموگلوبین جنینی.
آمیلوئیدوز خانوادگی ATTR استفاده موفق از CRISPR برای غیرفعالسازی ژن TTR در کبد برای جلوگیری از تجمع پروتئین سمی.
لوکودیستروفی متاکروماتیک درمان آزمایشی با هدف جایگزینی یا خاموشسازی ژن معیوب.
اختلالات بینایی ژنتیکی (مانند Leber’s Congenital Amaurosis)استفاده از CRISPR برای ویرایش مستقیم شبکیه چشم؛ نتایج امیدوارکننده در فاز ۱و۲ انسانی.
2- مقابله با ویروسها و بیماریهای عفونی
HIV پژوهشها برای حذف ژن CCR5 در سلولهای ایمنی انسان که یک گیرنده اصلی برای ورود ویروس به سلولهای ایمنی است، در حال انجام هستند.
ویروس HPV غیرفعالسازی ژنهای سرطانزای HPV در سلولهای انسانی.
ویروس Epstein–Barr (EBV) حذف ژنهای ویروسی از سلولهای آلوده با استفاده از CRISPR.
کووید-۱۹ (SARS-CoV-2) استفاده از CRISPR-Cas13 برای شناسایی و از بین بردن RNA ویروسی در مدلهای سلولی.
- بیماریهای عصبی و مغزی
ALS (اسکلروز جانبی آمیوتروفیک) اصلاح جهش در ژن SOD1 در مدلهای حیوانی.
آلزایمر کاهش بیان ژن APOE4 با CRISPR در مدلهای موش.
سندروم داون حذف موفق کروموزوم ۲۱ اضافه در سلولهای بنیادی انسان (آزمایشگاهی، هنوز بالینی نشده).
هانتینگتون حذف جهش CAG تکراری در ژن HTT با استفاده از CRISPR در مدلهای جانوری.
- سرطان
ملانوم، سرطان ریه و غیره مهندسی سلولهای T با CRISPR برای حذف ژن PD-1 (تقویت ایمنی ضدسرطان).
سرطان خون (لوسمی) ویرایش CAR-T cells با CRISPR برای هدفگیری دقیقتر سلولهای سرطانی.
- کاربردهای کشاورزی و دامداری
برنج مقاوم به خشکسالی و آفت .اصلاح ژنها برای تحمل بیشتر در شرایط سخت اقلیمی.
ذرت با محتوای تغذیهای بالا تغییر در ژنهای متابولیسمی برای افزایش ارزش غذایی.
گوجهفرنگی، سیبزمینی، سویا، گندم اصلاح برای مقاومت به قارچ، باکتری، آفات یا افزایش رشد.
گاو بدون شاخ (polled) حذف ژن ایجاد شاخ برای جلوگیری از آسیب به حیوانات و انسانها.
ماهی سالمون سریعالرشد تغییر ژن تنظیمکننده رشد برای افزایش سرعت رشد ماهی.
- سایر موارد علمی و پزشکی
تشخیص بیماری (CRISPR diagnostics) استفاده از CRISPR-Cas12/13 برای شناسایی سریع ویروسها و باکتریها (مانند DETECTR، SHERLOCK).
ساخت مدلهای حیوانی با ژنهای انسانی برای بررسی عملکرد بیماریها یا تست دارو.
مهندسی زیستی (بیوسنتز دارو، آنزیم) ساخت باکتریهایی که مولکولهای دارویی خاص یا آنزیمهای صنعتی تولید میکنند.
تنظیم اپیژنتیک ژنها با CRISPR-dCas9 (نسخهای بدون برش) برای روشن/خاموشکردن ژنها بدون تغییر DNA.
کمپلکس CRISPR-Cas9 اولین ربات مولکولی:
اگرچه کمپلکس CRISPR-Cas9 عملکرد هوشمند و یا الگوریتم عملکرد درشرایط مختلف ندارد ، اما از نظر پیچیدگی عملکرد و تشکیل شده از چند عنصر عملکردی و امکان هدفگیری دقیق و نیز اجزاء همراه که باعث ورود آن به سلول و هسته می شود ، قطعا برازنده نام اولین ربات مولکولی است .
همانطوری که در بخش پزشکی مولکولی گفته شد ، ما ابتدا مکانیسمها را کشف میکنیم ، هرگاه قدرت پردازش به حدی برسد که بر محاسبات مربوط به تمام اتفاقات مسلط شویم ، قدرت اختراع ایجاد می شود . اگرچه بسیاری فرآیندهای مولکولی را استفاده میکنیم اما پزشکی مولکولی واقعی وقتی است که اساسا چیز جدیدی را اختراع کنیم . برای ساخت یک آنتی بادی مونوکلونال یا ایجاد یک گیرنده در سطح سلول مثلا در CARTCell therapy ما فقط باید چفت شدگی سر آنتی بادی یا سر گیرنده را با یک اپیتوپ خاص ، محاسبه ، شبیه سازی و پیشبینی کنیم که الان این کار در حال انجام است زیرا تعداد اسیدهای آمینه دوطرف نسبتا محدود و محاسبه تمام اشکال و بارهای سطحی و ارتباط در حدی است که قدرت محاسباتی فعلی جوابگو است و البته قوانین و ریاضیات مربوطه کاملا شناخته شده است .
اما برای ساخت یک آنزیم ، محاسبه تاثیر تک تک اسیدهای آمینه محاسبات بسیار بیشتری را میطلبد و البته قوانین و ریاضیات وضعیتهای مختلف تا خوردن رشتهها و شکل نهائی و چفت شدگی آن با مولکولهای دیگر و عملکرد هنوز کاملا واضح نشده است و در حال حاضر و با قدرت پردازش فعلی امکانپذیر نیست .
فعلا باید از امکانات موجود در طبیعت استفاده کنیم ، اما بزودی خواهیم توانست به این قدرت از محاسبات برسیم ورباتهای واقعی مولکولی را بر پایه آنزیم ها و ترکیب با سایر مولکولهای حیاتی طراحی کنیم .
از نظر تعریف ، ربات واقعی ضمن اینکه باید بتواند به هدف برسد و هدفمند عمل کند ، باید بتواند قدرت واکنشهای مختلف در وضعیتهای مختلف داشته باشد و این اطلاعات نوع عملکرد به نوعی در آن ذخیره شده باشد . و مشخص است هنگامی که به این هدف در مورد ویرایش ژن برسیم ، چه امکان بزرگی در اختیار خواهد بود .